太震撼了!科学家首次看清全身所有癌症转移灶
2019-12-16 10:22:47 奇点网 大健康
虽然我知道癌症转移很厉害,90%的癌症死亡是转移导致的。
但是,当我看到最新一期《细胞》封面展示的肺转移时,还是被数不清的转移灶震撼到了。
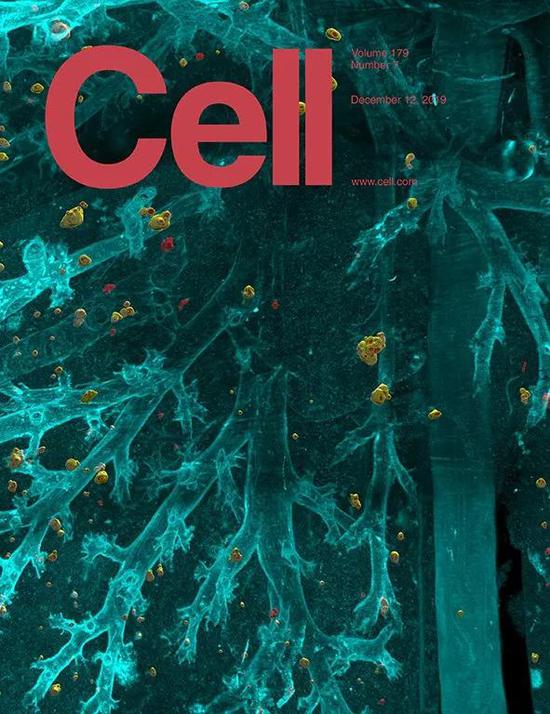 ▲ 封面图片(肺转移):黄色是被抗体靶向的转移位点,红色是抗体漏掉的转移位点
▲ 封面图片(肺转移):黄色是被抗体靶向的转移位点,红色是抗体漏掉的转移位点
你没看错,上面那些形状不规则、大小不一的小点点,就是小鼠肺里面的癌症转移灶。其中黄色的是被抗体药物结合的肿瘤,红色的是被抗体药物漏掉的肿瘤。
是的,即使是被寄予厚望的抗体药物,也不能打入所有的转移灶。也就是说,治疗总会有漏网之鱼。
我们今天能清晰地看清楚癌症在肺部形成的转移灶,甚至是单个癌细胞形成的转移位点,这得感谢德国组织工程和再生医学研究所的科学家们。
 ▲ 肺癌转移动图(红色的是小肿瘤)
▲ 肺癌转移动图(红色的是小肿瘤)
在Ali Ertürk教授的带领下,中国青年科学家潘晨琛博士在一个叫vDISCO的成像黑科技的基础上,开发了一个能处理3D影像的DeepMACT的人工智能算法[1]。
有了这两套技术,科学家就可以在小鼠体内找到转移到全身各处的转移位点。与之前的技术相比,这个技术平台首次让科学家得以看到单个癌细胞形成的转移位点。
更厉害的是,这个技术平台还能显示出哪些转移位点已经被抗体药物结合了,哪些被漏掉了。让研究人员吃惊的是,竟然有23%的转移位点被抗体药物漏掉,这或许也是癌症容易复发的原因之一。
这项开创性的研究成果,以《细胞》封面文章的形式发表,共同第一作者是潘晨琛、Oliver Schoppe和Arnaldo Parra-Damas。
 ▲ 潘晨琛(右三)和Ali Ertürk教授(右四)
▲ 潘晨琛(右三)和Ali Ertürk教授(右四)
在介绍研究内容之前,我们还是有必要一起来了解一下研究背景。
研究背景——现有技术不行
我们都知道,癌症是数一数二的杀手。而癌症导致的死亡,90%与转移有关。因此,全面了解癌症在全身转移的状况,对于抗癌药物研发的重要性可想而知[2]。
然而,由于技术本身的限制,目前的检测手段(例如,生物发光和MRI等)的分辨率非常有限,很难对癌症转移的情况做全面的分析。尤其是散落在身体各处只有一个癌细胞的转移位点,当前的手段根本就发现不了。还有个限制是,即使我们能获取全身的转移成像数据,目前的分析方法也是非常慢的,没有几个月也下不来。
在Ertürk教授的团队看来,基于当前的技术平台,想全面深入地了解癌症转移的路径和机制,是一件不可能完成的事情。
这就是他们要解决的问题。
 ▲ 潘晨琛本尊
▲ 潘晨琛本尊
摆在他们面前的第一个问题是:如何能尽可能地找到所有的转移位点,哪怕是只有一个癌细胞的最小转移位点。
vDISCO——能看到单个癌细胞形成的转移位点的黑科技
这个问题难不住他们。就在去年年底,潘晨琛与Ertürk教授的第一个博士生蔡瑞瑶联合发明了一个叫做vDISCO的成像黑科技[3]。
有了这项技术,他们可以把已经接种肿瘤,且肿瘤已经转移的小鼠变成无色透明的状态(具体操作方法见论文)。
 ▲ 你没看错,这确实是小鼠,虽然看上去特别爽口
▲ 你没看错,这确实是小鼠,虽然看上去特别爽口
vDISCO还有个绝招是,可以把癌细胞携带的荧光蛋白信号增强100倍以上。这样就可以忽略小鼠身体的荧光背景干扰,不仅可以轻易看到深埋在几厘米厚的组织中的大型肿瘤转移位点,甚至还能看到只有一个癌细胞构成的转移位点。
在本研究中,他们采用了已经转入荧光基因的乳腺癌细胞系。将这些特殊的癌细胞移植到小鼠身上之后,让肿瘤自由生长、转移6到10周。然后将小鼠变成透明的状态。
他们首先测试了vDISCO是否可以检测到只有一个癌细胞的微小转移位点,并将其与生物发光成像技术做了个比较。
生物发光成像技术定位了一些大的转移位点,但是看不到关于这个位点的实际大小和形状等细节信息,微小的转移灶根本就看不到(下图A-G)。相较而言,vDISCO不仅能够看清楚大转移位点的细节,还能清晰地看到由一个癌细胞组成的转移位点(下图N)。
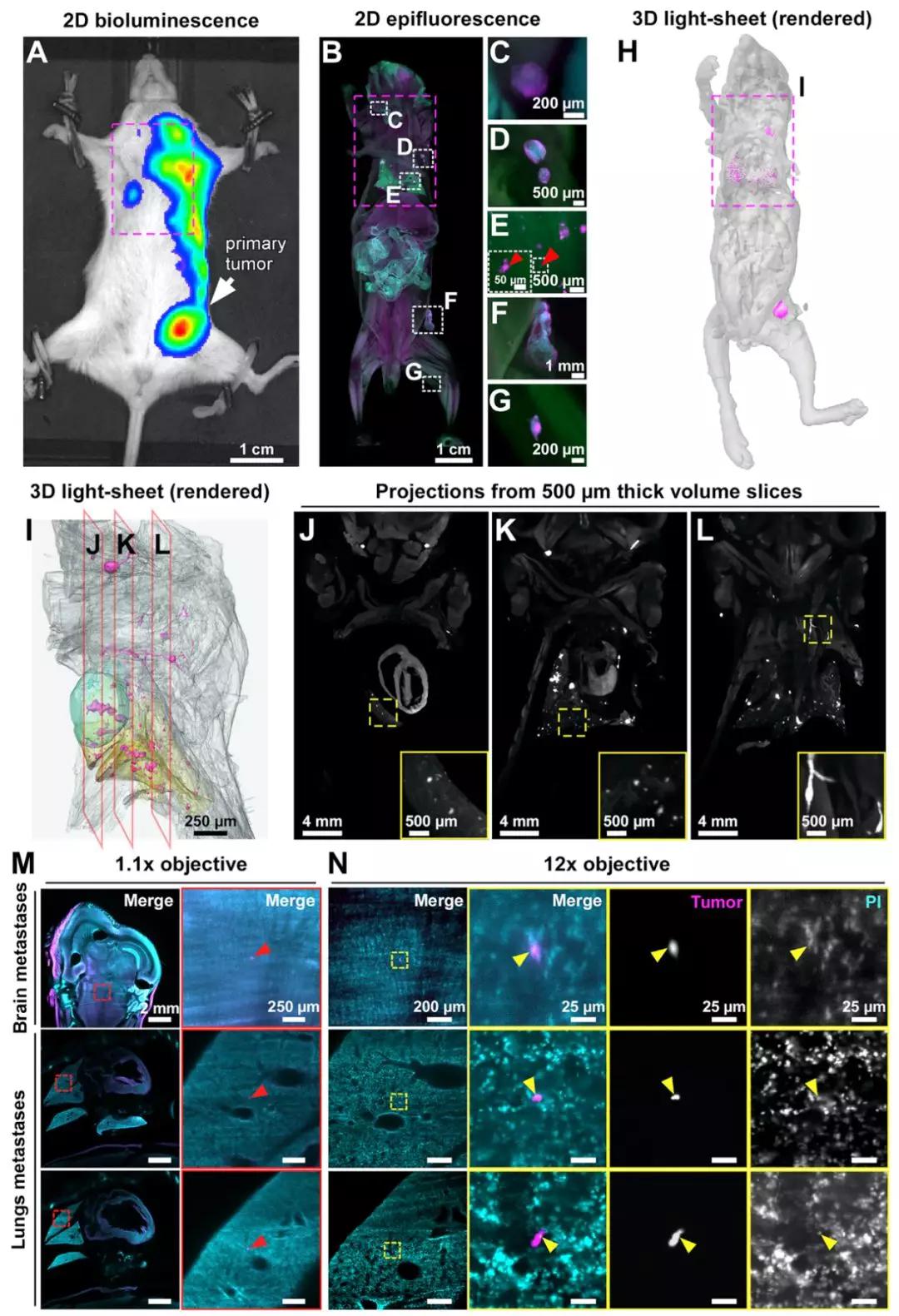 ▲ 生物发光技术与vDISCO的比较
▲ 生物发光技术与vDISCO的比较
这也是科学家首次在小鼠全身3D扫描中看到由一个癌细胞组成的转移位点。
 ▲ 快看,那些红色的小点点,就是转移位点
▲ 快看,那些红色的小点点,就是转移位点
DeepMACT——能准确分析单个癌细胞转移位点的人工智能平台
Ertürk教授团队面临的第一个问题,在他们之前工作的基础上,顺利地解决了。看完上面的那张动图,我想你肯定已经看出来了,vDISCO成像的数据量非常复杂、非常大。
如果用传统的方法处理这些数据的话,据研究人员估计,需要的时间是几个月。而且,即使花了数月完成分析,质量可能也不高(例如,有可能会漏掉很多微小的转移位点)。
为了解决这个问题,潘晨琛等基于卷积神经网络(CNN),开发了一个叫做DeepMACT的人工智能分析平台。用DeepMACT处理vDISCO的图像数据,只需动动鼠标,在几个小时之内就能完成。
 ▲ DeepMACT的设计原理
▲ DeepMACT的设计原理
以上就是本研究涉及的两个核心技术DeepMACT和vDISCO。那么它们两个“双剑合璧”的效果究竟如何呢。让我们接着往下看。
首先看看乳腺癌在小鼠体内的微小转移位点。
肺里面布满了微小转移位点
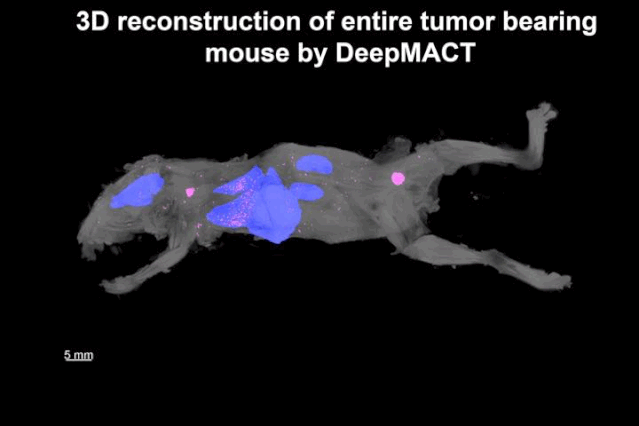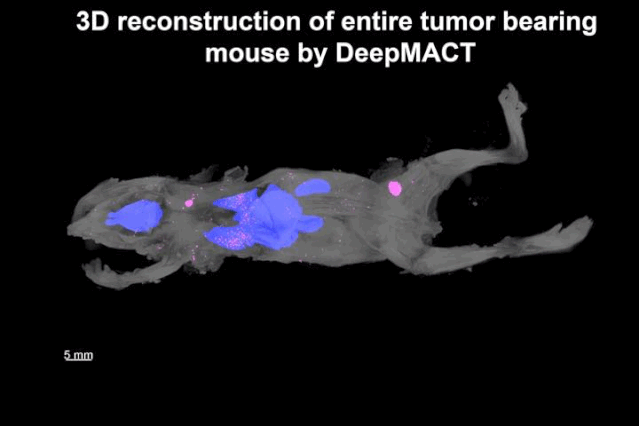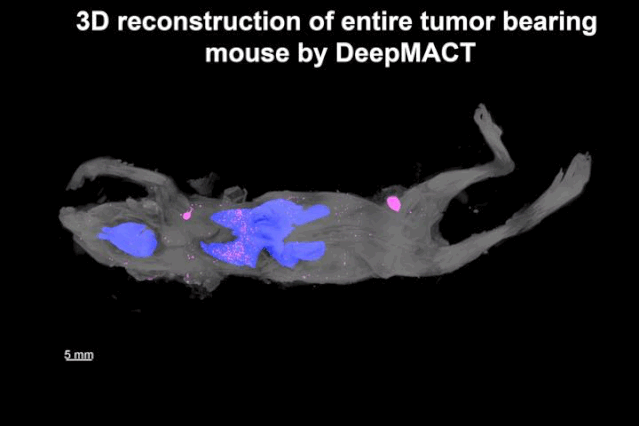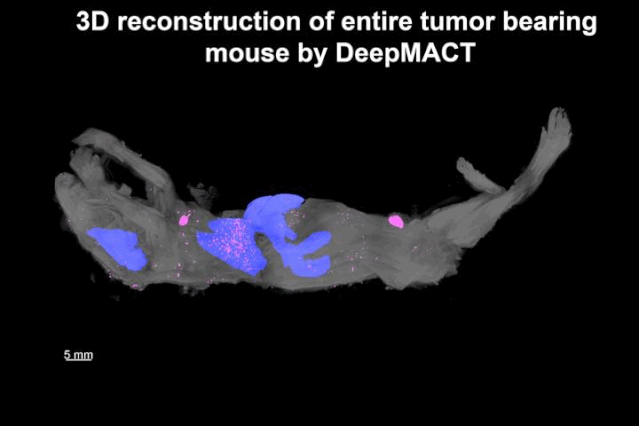
潘晨琛等发现,除了原发肿瘤灶和腋窝淋巴结的大转移以外,还检测到520个大小不等的微转移,遍及全身,其中肺部就有306个。而且,绝大部分微小转移位点深埋体内,距离体表1厘米左右。这些小转移位点,其他方法基本是检测不到的。
 ▲ 转移位点的分布图
▲ 转移位点的分布图
具体到肺部的306个小转移位点而言,它们是均匀地分布在小鼠的肺叶之中,无论大小,都是随机分布的。79%的微小转移位点与邻居之间的距离在1毫米以内。也有一些孤立的微小转移位点,与周边其他位点的距离在9.3毫米以上。
更重要的是,他们发现了大量直径小于50到100微米的超小转移位点,它们大多由几百个,甚至更少的癌细胞组成。此外肺部微小转移灶的负荷,较其他部位高出100倍,而且肺部微小转移位点的体积比躯干的微小转移位点要大出30%左右。
随后,他们还在肺癌和胰腺癌等模型中,验证了这项技术的可靠性。
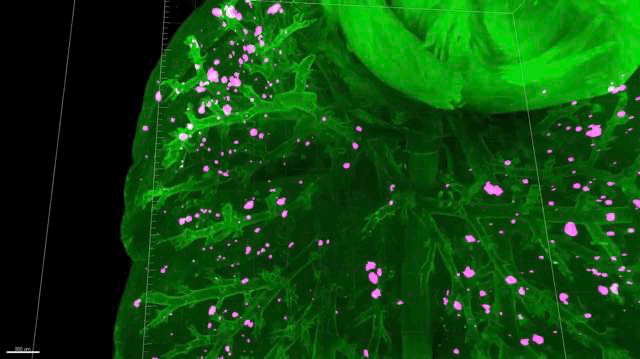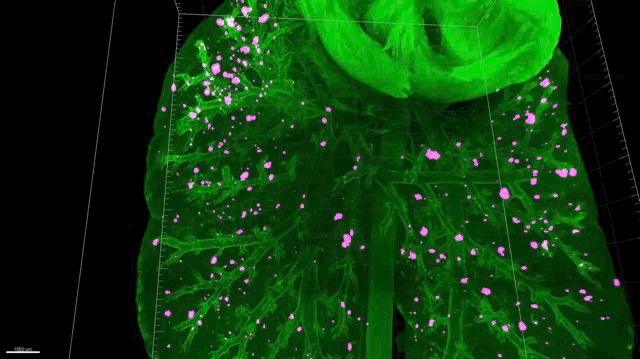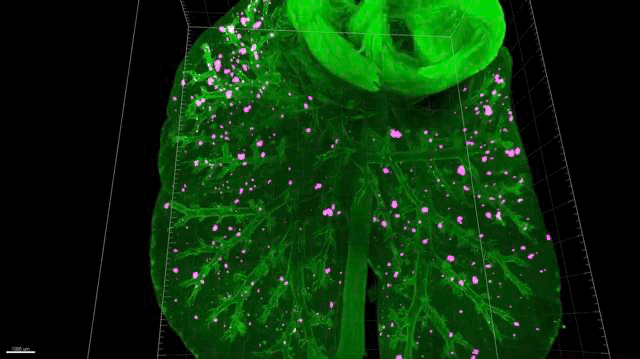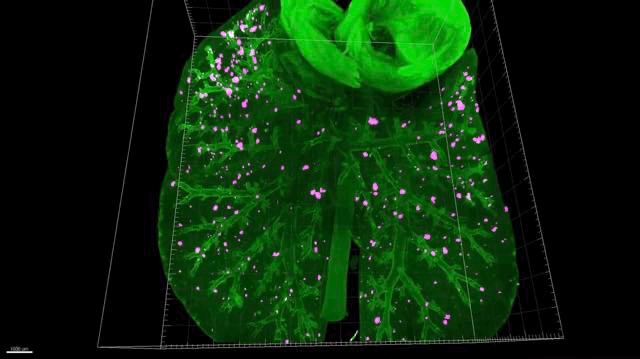 ▲ 肺癌转移动图
▲ 肺癌转移动图
在研究论文的最后一部分,潘晨琛等用vDISCO和DeepMACT,检验了抗体药物的治疗效果。
抗体药物可能会漏掉23%的转移位点
我们都知道,抗体药物是一种重要的治疗手段,尤其是本世纪初兴起的免疫治疗,可以说是改变了癌症的治疗规则。但是,到目前为止,还没有人从全身的层面,分析抗体药物的分布,尤其是抗体药物有没有“剿灭”散布于全身各处的癌细胞。
为了研究这个问题,潘晨琛等选择了癌细胞中的碳酸酐酶XII(CA12)为治疗靶点,对应的治疗性抗体药物为6A10[4,5]。之前已经有研究表明,这个6A10抗体可以抑制肿瘤的生长[6]。只不过在本研究中,研究人员给6A10做了一些修饰,加了个小尾巴,便于检测。
在肿瘤移植后的第9周,研究人员给小鼠注射6A10,两周后透明处理。
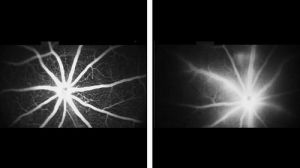
总体来看,小鼠全身只有77%的转移位点能检测到6A10的存在。其中肺部的是85%,其他部位只有66%。这意味着,即使像抗体这种有靶向性,且亲和力高的药物,也会漏掉23%的转移位点。
 ▲ 肺转移,还有很多“漏网之鱼”(红色)
▲ 肺转移,还有很多“漏网之鱼”(红色)
这背后的机制吸引了潘晨琛等的思考。
他们首先想到的是,这可能与血管的分布有关。毕竟药物是随着血液才能抵达肿瘤的。如果某个位点周围没有血管的话,抗体药物抵达不了,也可以理解。
不过真相并不是这样。潘晨琛等发现,实际上在每个被抗体药物漏掉的转移位点附近1-6微米左右就存在血管。这个距离甚至小于细胞的直径(10微米),这说明血管不是这个现象的主要原因[7]。
潘晨琛等想到的第二个原因是微环境。接下来他们分析了被抗体识别位点之间,以及没有被靶向的位点之间的距离。结果显示,被靶向的位点之间最近距离约0.8毫米,那些没有被靶向的位点之间最近距离在1.7-2毫米之间。
基于此,他们认为,是转移位点的微环境影响了抗体药物的效率。当然,具体机制还有待进一步研究。
 ▲ 肺转移,有很多“漏网之鱼”(红色)
▲ 肺转移,有很多“漏网之鱼”(红色)
“之前的成像技术是无法检测到转移位点的这些特征的,DeepMACT是第一种能对全身转移位点做定量分析的方法。”潘晨琛说[8],“而且,我们开发的这种方法还能让我们更好的了解抗体药物的靶向性。”
确实如此,潘晨琛博士等开发的这项技术,让我们深入地认识了癌症转移的凶险。在体积那么小的小鼠体内竟然有500多个微小转移位点,换做是人类的话,真是不敢想象。
基于这项技术,科学家不仅可以更好的了解不同癌症的转移特征,还能筛选出靶向效果更好的抗体药物。这无论是对于癌症转移的基础研究,还是抗癌新药的研发,都有非常大的使用价值。
目前,DeepMACT是对外开放的,所有的科学家都可以使用。“现在抗癌新药的研发成功率只有5%左右,DeepMACT或许可以改善药物研发过程,帮助科学家找到更强大的抗癌药。挽救更多的生命。”Ertürk教授说[8]。